製品・サービス
CFSE T細胞増殖アッセイ
ProImmune 社のCFSE T細胞増殖アッセイを用いることで、ヘルパーT細胞の増殖を引き起こすエピトープの配列を同定することが可能です。
これにより、ヘルパーT細胞による免疫応答を引き起こしうるエピトープを同定できます。
従来使用されてきた放射性チミジンを用いるアッセイ法とは異なり、このアッセイ法はフローサイトメトリー法を利用することで、感度の劇的な向上とその効果により、増殖するCD4+ 細胞の割合や詳細なT細胞応答の内容を決定することが可能となります。
T細胞増殖アッセイにより潜在的なT細胞エピトープの存在/ 非存在を同定することが可能であり、新規のペプチドやタンパク質を用いた薬剤の非臨床における評価に有用です。
このアッセイを用いることで、類似の構造を持つ分子間の相対的免疫原性を評価することができます。
例えば候補薬剤間の比較や、免疫原性を低減するための改変方針策定のためのガイド等として利用することができます。
ナイーブ プライマリT細胞増殖アッセイ
本アッセイはヘルパーCD4+ T細胞の増殖を引き起こすペプチドエピトープを同定することにより、抗薬剤抗体反応やその他の望ましくない免疫応答を生じるヘルパーT細胞応答を引き起こす可能性があるペプチドエピトープを同定することが可能です。
また、本アッセイを利用することにより、免疫療法で用いられるエピトープの探索など、免疫原として認識されるためのタンパク質部分配列を同定することも可能です。
方法の概略
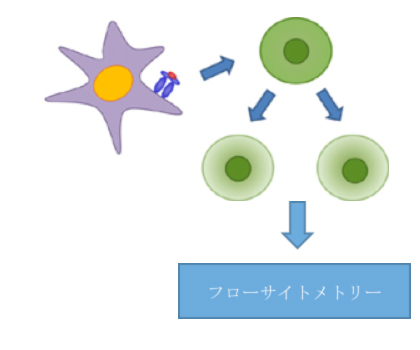
図1
CD4+T細胞の増殖により、CFSEラベルの希釈化が生じ、CD4およびCFSEに関するフローサイトメトリーによる分析により細胞分裂を定量化
結果の解釈
各ペプチド刺激を受けたサンプルに対し、バックグラウンドの影響を除去したpercentage stimulationが算出されます。
Percentage stimulationは活性化されたCD4+ CFSE細胞集団の全CD4+細胞集団に対する割合として表現されます。
バックグラウンドの影響を除くため、刺激を受けたサンプルに対する活性化細胞のパーセンテージから刺激を受けていないサンプルに対する活性化細胞のパーセンテージを引いた値が計算されます。
各ペプチドに対する計算値は、6重に測定された値の平均値として算出されます。
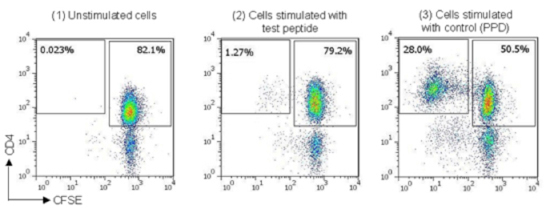
図2
バックグラウンドの影響を除去したpercentage stimulationの値が0.5%を超え、かつバックグラウンドに関する標準誤差の2倍以上である場合に陽性と判断することができます。
わずかな反応を検出するため、より緩やかな基準を設ける場合もあります。
ペプチドに対し基準を超える反応を示したドナーの割合をPercentage antigenicityとして計数します。
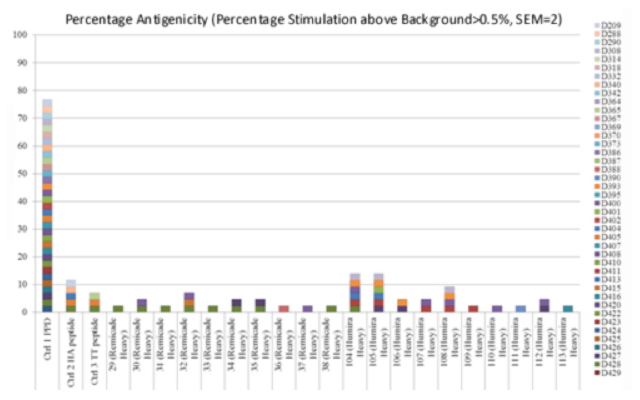
図3
ペプチド間の比較を行うため、response indexが計算されます。
この値は応答の強さを示すバックグラウンドの影響除去後のpercentage stimulationと応答の頻度を示すpercentage antigenicityの積として計算されます。
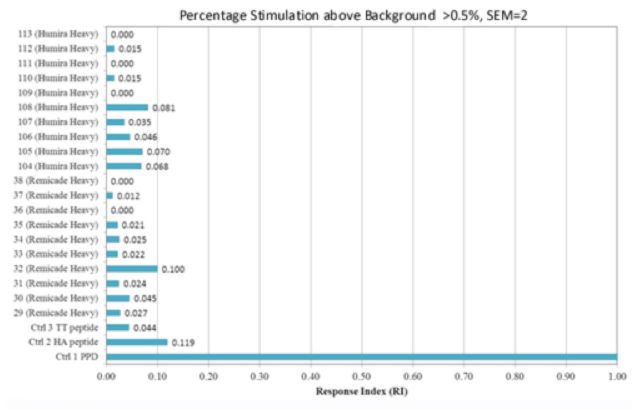
図4
レポートに含まれるデータ
- percentage antigenicity
- response index
- 閾値をp<=0.05としたANOVAによる応答の大きさ
DC-T細胞アッセイ
この高感度かつ様々な用途に適用可能なアッセイを使用することで、候補タンパク質が抗薬剤抗体応答やそのほかの望ましくない免疫反応が生じる原因となるヘルパーCD4+ T細胞増殖を引き起こすかどうかの試験を行うことが可能です。
CD4+ T細胞増殖は細胞増殖を測定するための高感度の方法、CFSE染色試料の希釈による蛍光の減少により測定されます。 この全長タンパク質のためのアッセイは様々な応用法があります。
タンパク質間の相対的免疫原性を比較することのみでなく、剤形処理されたタンパクに関しても使用可能であるため、タンパク質配列以外の要素による免疫原性に与える影響を評価することも可能です。
これには、
- バイオシミラー間の比較
- タンパク質の修飾による影響
- 分解産物による影響
- 併用療法における併用薬剤による影響
- 生産工程の違いによる影響
- 賦形剤による影響
- 剤形による影響
等の評価も含まれます。 また、例えば抗原が応答に関係するT細胞の機能を修飾する働きがある場合等では抗原を直接PBMCの刺激に使用することが出来ない場合があります。
この場合でもDC細胞を用いることにより、アッセイのへの干渉を避けてリード間の相対的な免疫原性を測定することが可能です。
方法の概略
このアッセイではProImmune社でバンキングしている高分解能MHC classII組織タイピング済み健常人ドナーサンプルが用いられます。
ドナーはご希望のタイプ分布を反映するように選択することも、全世界のタイプ分布を反映するように選択することもどちらも可能です。
試験のスケールに応じて20, 40または50ドナーからのサンプルを使用した試験を行うことが可能です。
ドナーから採取されたPBMCはMonocyteの供給源として使用され、monocyteは培養されて未成熟DC細胞となります。
DC細胞は抗原に暴露され、さらに培養されることで成熟した表現型へと変化します。
次に同一ドナー由来のPBMCからCD8+ T細胞を除去してCFSEでラベルし、成熟したDC細胞と混合します。
これにより生じるCD4+ T細胞の増殖をモニターすることにより全長タンパク質の免疫原性を評価します。

図5
陰性コントロールとして抗原未処理のサンプルと陽性コントロールとして抗原性が知られているタンパク質で処理したサンプルの結果も付属します。
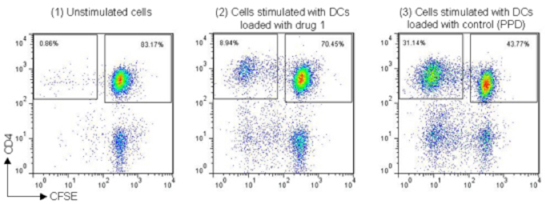
図6
結果の解釈
各ペプチド刺激を受けたサンプルに対し、ナイーブ プライマリT細胞アッセイと同様、バックグラウンドの影響を除去したpercentage stimulationが算出されます。
Percentage stimulationは活性化されたCD4+ CFSE細胞集団の全CD4+細胞集団に対する割合として表現されます。
バックグラウンドの影響を除くため、刺激を受けたサンプルに対する活性化細胞のパーセンテージから刺激を受けていないサンプルに対する活性化細胞のパーセンテージを引いた値が計算されます。
バックグラウンドの影響を除去したpercentage stimulationの値が0.5%を超え、かつバックグラウンドに関する標準誤差の2倍以上であるドナーが2名以上存在する場合に陽性を示唆すると考えることができます。
この陽性ドナーの頻度は免疫原性を評価する際に重要な意味を持ちます。
陽性ドナーの応答に関して、その強度を考慮することも重要です。
強度は各薬剤に対する全ドナーに関するバックグラウンドの影響を除去したpercentage stimulation値の平均で表されます。
Response Indexは上記頻度と強度の積として計算されます。
この指数は頻度や強度単独の値より免疫原性のレベルを忠実に反映します。
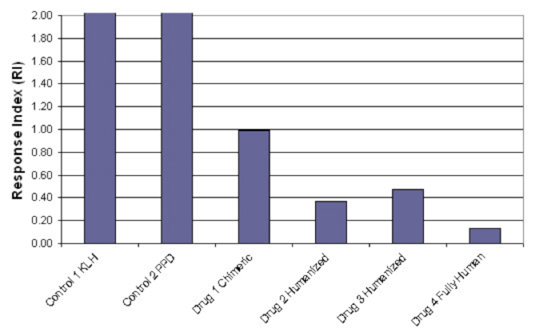
図7
