製品・サービス
ペプトイドとN-アルキル化ペプチドの構造と特徴
アミド結合はペプチドのアミノ酸間の主な構成要素で、非常に多くのビルディング・ブロックとの組み合わせによる生物学的および化学的な手法により、無限に近い種類の新規の優れた特性を持つ材料だけでなく、生物学的な活性を有する物質の迅速な合成を可能にします。
しかし、ペプチド結合にはそのプロセスを妨げる酵素分解に対する不安定性うあ生体膜および生体内のバリアを構造を保ったまま通過できないという重大な欠点があり、研究開発を経て上市されるまでに壁として立ちふさがります。
ペプチドの優れた生物学的活性を保持、もしくは改善しながらこれらの欠点を克服する一つの方法に、自然界でも使用されてきたアミド結合のアルキル化があります。
より立体的に遮蔽されたアミド結合を形成することで酵素によるタンパク質分解に対する安定性を増大させます。
また一方で、極性を持ち、水素結合を形成するアミドプロトンをアルキル基に置き換えることで膜透過性が改善されます。
さらに、N-アルキル基は剛性を高め、立体配座空間を少なくすることで受容体への選択性を改善することができるため、望ましくない副作用を回避することができます 1 2 3。
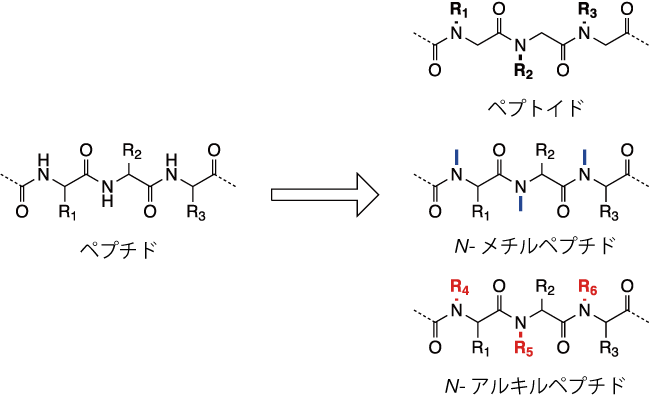
図1. ペプチドからペプトイドへの変換
ペプトイドという言葉は、1990年代初頭にBartlettと共同研究者によって、N-置換グリシンのオリゴマーのことを指すようになりましたが 4 5、これより以前にも例は存在していました。
もともとペプトイドは、単純なアキラルな試薬を用いてモジュラー合成により非常に多くの種類のビルディングブロックを用いて高速かつ効率的な合成を可能にするために設計されており、アミド結合の修飾によって酵素的安定性が増加し、立体中心が失われるため、ペプトイドは対応するペプチドよりも自由度の大きいコンホメーションを有します。
今日ではペプトイドという言葉は、N-アルキル化された単一または複数のアミド結合を有する任意のペプチドを含む化合物まで、より広い範囲に適用されており、N-メチルペプチド 6にまで拡大されています。
数多く存在するペプトイドおよびN-アルキルペプチドのアプリケーションは、多くの異なる治療分野での研究にリンクしており、これらの化合物の中で最もよく知られた例としては天然物シクロスポリンA(図2.)が挙げられます。
免疫抑制剤として1970年代から使用され、初めて心臓移植を可能したということでも有名ですが、おそらくそれ以上に有名なのは経口投与可能な修飾されたペプチドであるということです 7 8 9 10 11 。
ペプトイドは、抗菌性ペプチド(Antimicrobial Peptide, AMP)と同様の抗菌活性を有する上にペプチドに比べて高い安定性と生物学的利用能を有することが見出されており12、またハンチントン病のような難病の潜在的治療薬としても期待されています13。
革新的かつ安定した合成方法と改良された試薬や幅広いビルディングブロックが入手可能になったことで、最近ではこれらの化合物を用いた研究が発展するとともに、多くの関心が寄せられています(図2.、14 15)。
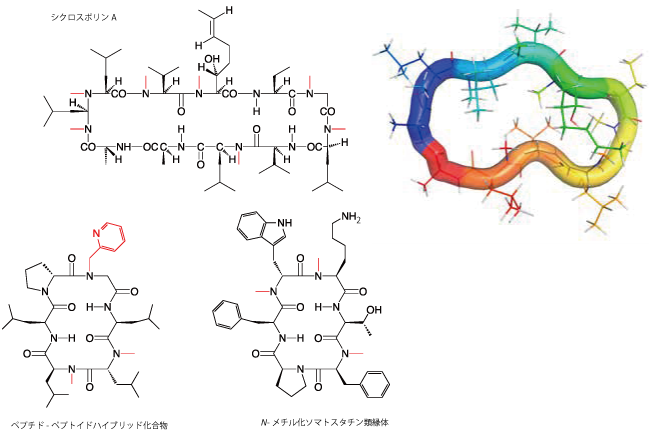
図2. ペプトイドとN-メチル化されたペプチドモチーフを含有する環状ペプチド
参考文献
- Synthesis of N-Alkylated Peptides; C. Gilon, M. A. Dechantsreiter, F. Burkhart, A. Friedler and H. Kessler; Houben-Weyl: Methods of Organic Chemistry 2003; E 22c: 215-271. [return]
- A conformationally frozen peptoid boosts CXCR4 affinity and anti- HIV activity; O. Demmer, A. O. Frank, F. Hagn, M. Schottelius, L. Marinelli, S. Cosconati, R. Brack-Werner, S. Kremb, H. J. Wester and H. Kessler; Angew Chem Int Ed Engl 2012; 51: 8110-8113. doi:10.1002/ anie.201202090. [return]
- New, potent, and selective peptidic oxytocin receptor agonists; K. Wisniewski, S. Alagarsamy, R. Galyean, H. Tariga, D. Thompson, B. Ly, H. Wisniewska, S. Qi, G. Croston, R. Laporte, P. J. Rivière and C. D. Schteingart; Journal of Medicinal Chemistry 2014; 57: 5306-5317. doi:10.1021/jm500365s. [return]
- (a). Peptoids: a modular approach to drug discovery; R. J. Simon, R. S. Kania, R. N. Zuckermann, V. D. Huebner, D. A. Jewell, S. Banville, S. Ng, L. Wang, S. Rosenberg, C. K. Marlowe and et al.; Proc Natl Acad Sci U S A 1992; 89: 9367-9371.
(b). Design, Synthesis, Assembly, and Engineering of Peptoid Nanosheets; Ellen J. Robertson, Alessia Battigelli, Caroline Proulx, Ranjan V. Mannige, Thomas K. Haxton, Lisa Yun, Stephen Whitelam, and Ronald N. Zuckermann; Acc. Chem. Res., Article ASAP 2016; DOI: 10.1021/acs.accounts.5b00439. [return] - (a). Efficient Method for the Preparation of Peptoids [Oligo(NSubstituted Glycines)] by Submonomer Solid-Phase Synthesis; R. N. Zuckermann, J. M. Kerr, S. B. H. Kent and W. H. Moos; Journal of the American Chemical Society 1992; 114: 10646-10647.
(b). Solid-phase Submonomer Synthesis of Peptoid Polymers and their Self-Assembly into Highly-Ordered Nanosheets. Tran, H.; Gael, S.L.; Connolly, M.D.; Zuckermann, R.N.; J. Vis. Exp. 2011; 57: e3373. DOI: 10.3791 / 3373; http://www.jove.com/video/3373. [return] - Macrocyclic Peptoids: N-Alkylated Cyclopeptides and Depsipeptides; L. Wessjohann, C. K. Z. Andrade, O. E. Vercillo and D. G. Rivera; Targets in Heterocyclic Systems: Chemistry and Properties 2006; 10: viii + 360 pp. doi:10.1021/ja801048k. [return]
- Cyclosporin-a, a Peptide Metabolite from Trichoderma-Polysporum (Link Ex Pers) Rifai, with a Remarkable Immunosuppressive Activity; A. Ruegger, M. Kuhn, H. Lichti, H. R. Loosli, R. Huguenin, C. Quiquerez and A. V. Wartburg; Helvetica Chimica Acta 1976; 59: 1075-1092. [return]
- NMR studies of [U-13C] cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding; S. W. Fesik, R. T. Gampe, H. L. Eaton, G. Gemmecker, E. T. Olejniczak, P. Neri, T. F. Holzman, D. A. Egan, R. Edalji, R. Simmer, R. Helfrich, J. Hochlowski and M. Jackson; Biochemistry 1991; 30: 6574-6583. [return]
- Structure refinement of cyclosporin a in chloroform by using RDCs measured in a stretched PDMS-gel; J. Klages, C. Neubauer, M. Coles, H. Kessler and B. Luy; ChemBioChem 2005; 6: 1672-1678. [return]
- Peptide conformations. Part 31. The conformation of cyclosporin A in the crystal and in solution; H. R. Loosli, H. Kessler, H. Oschkinat, H. P. Weber, T. J. Petcher and A. Widmer; Helvetica Chimica Acta 1985; 68: 682-704. [return]
- Design of Cyclic Peptides; O. Demmer, A. O. Frank and H. Kessler; Peptide and Protein Design for Biopharmaceutical Applications 2009; 133-176. [return]
- Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides; N. P. Chongsiriwatana, J. A. Patch, A. M. Czyzewski, M. T. Dohm, A. Ivankin, D. Gidalevitz, R. N. Zuckermann and A. E. Barron; Proc Natl Acad Sci U S A 2008; 105: 2794-2799. doi:10.1073/pnas.0708254105; 0708254105 [pii]. [return]
- Expanded polyglutamine-binding peptoid as a novel therapeutic agent for treatment of Huntington’s disease; X. Chen, J. Wu, Y. Luo, X. Liang, C. Supnet, M. W. Kim, G. P. Lotz, G. Yang, P. J. Muchowski, T. Kodadek and I. Bezprozvanny; Chemistry & Biology 2011; 18: 1113-1125. doi:10.1016/j.chembiol.2011.06.010; S1074-5521(11)00232-8 [pii]. [return]
- Peptide to Peptoid Substitutions Increase Cell Permeability in Cyclic Hexapeptides; J. Schwochert, R. Turner, M. Thang, R. F. Berkeley, A. R. Ponkey, K. M. Rodriguez, S. S. Leung, B. Khunte, G. Goetz, C. Limberakis, A. S. Kalgutkar, H. Eng, M. J. Shapiro, A. M. Mathiowetz, D. A. Price, S. Liras, M. P. Jacobson and R. S. Lokey; Organic Letters 2015; 17: 2928-2931. doi:10.1021/acs.orglett.5b01162. [return]
- Intestinal permeability of cyclic peptides: common key backbone motifs identified; J. G. Beck, J. Chatterjee, B. Laufer, M. U. Kiran, A. O. Frank, S. Neubauer, O. Ovadia, S. Greenberg, C. Gilon, A. Hoffman and H. Kessler; Journal of the American Chemical Society 2012; 134: 12125-12133. doi:10.1021/ja303200d. [return]
