製品・サービス
フッ素化アミノ酸
概要
フッ素化されたアミノ酸は、ペプチドおよびタンパク質に有利な生物物理学的、化学的および生物学的特性を与えるという点で非常に注目を集めている化合物です。
全ての元素の中で最高の電気陰性度を有するフッ素の独特な性質は、隣接する基にも影響を及ぼし、ペプチドおよびタンパク質の極性、親油性、特定の側鎖の酸性/塩基性およびコンフォメーションにユニークな特性を与え、安定性、折りたたみ速度および活性を変化させます。

図1. トリフルオロメチル基は高い極性を示します
究極的には、セリンに対応するα-トリフルオロメチルアミノ酸またはヒドロキシ官能基におけるα-アミノ官能基は、標準的なSPPSプロトコール中に保護される必要はありません。電子吸引性が高く、α-トリフルオロメチル基の求核性が、アシル化が起こらない程度に大幅に低減されるためです。
欠点としては、アミド結合を形成するために、より強力なアセチル化の手法を検討する必要があることです。
この場合、通常のFmoc保護されたアミノ酸とフッ素化されたアミノ酸からなるジペプチドビルディングブロックを使うことがこの問題を解決する最も簡単な方法といえます。
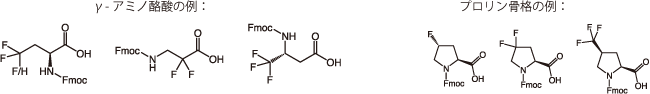
図2. トリフルオロメチル基が導入されたγ-アミノ酪酸とプロリン骨格の例
γ,γ-ジフルオロアミノ酸
β位にフッ素を導入すると、α位のC-H酸性度が上昇するため、ラセミ化が比較的容易に起こります。
しかしながらγ位での置換の場合はその数が1つであれ2つであれ、誘導体の光学的配座は維持されます。
Iris Biotech社のプラットフォームでは、目的のペプチドへの構造的多様性、極性、親油性、新しいコンフォメーションおよびフォールディングを実現するのに有用な数多くのγ,γ-ジフルオロアミノ酸をご提供可能です。
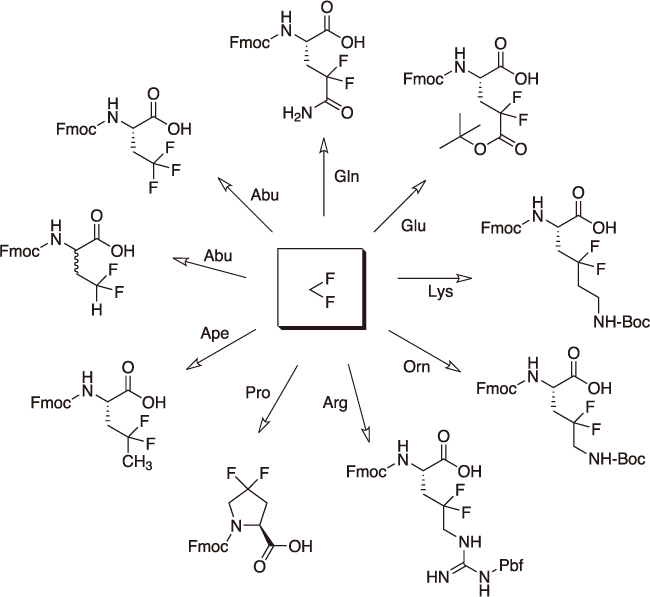
図3. 各種アミノ酸のγ、γ-ジフルオロ化
側鎖におけるトリフルオロメチル基
トリフルオロメチル基は、Phe、TrpおよびTyrの芳香族環や、チオール、ヒドロキシルまたはアミンのような官能基にも付加することが可能で、メチル基の水素を置換することによって形成することが可能です。
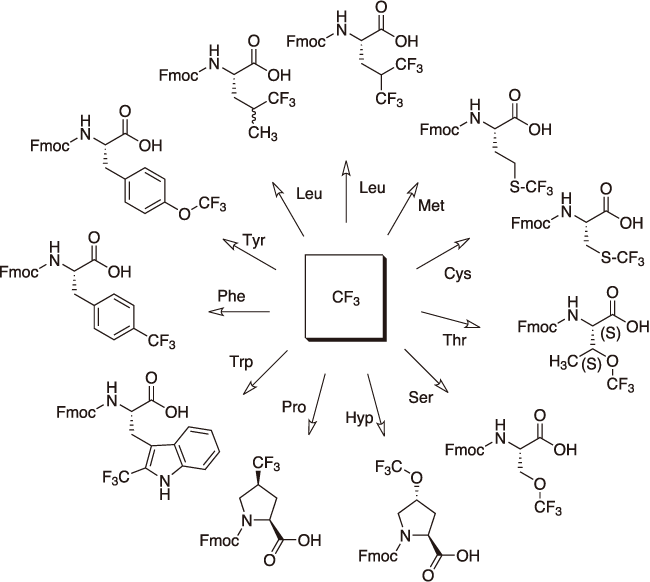
図4. 各種アミノ酸の側鎖に対するトリフルオロメチル基付与
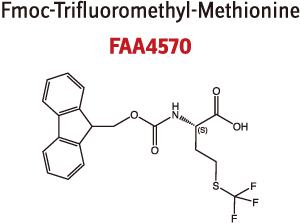
図5. トリフルオロメチル基を有するカタログ製品の一例
表1. 側鎖にトリフルオロメチル基を付与された製品
| コード | 製品名 | 分子式 | CAS | 分子量 | 内容量 | 名称 |
| FAA4570.0000 | Fmoc-L-TFM-OH | C20H18F3NO4S | 928654-78-8 | 425.42 | お問い合わせください | N-alpha-(9-Fluorenylmethyloxycarbonyl)-S-trifluoromethyl-L-methionine |
α-トリフルオロメチルアミノ酸
Cα-メチルアミノ酸はキラル中心での立体的な制限が増加することにより、特定の立体配座を取りやすい傾向にあることが特徴です。自己集積化を誘発することさえあるフッ素の強い分極特性を有するトリフルオロメチル基と組み合わさることにより、この特徴が更に強化されます。
これらのアミノ酸は、19 F-NMRのための標識としても有用です。
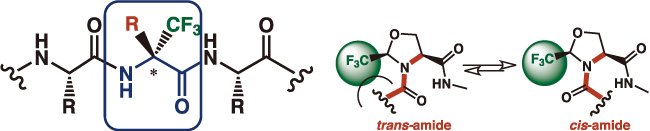
図6. α-トリフルオロメチルアミノ酸

図7. カタログ製品としてご提供可能なα-トリフルオロメチルアミノ酸
トリフルオロメチル基を含むビルディングブロックのペプチドへの組み込みは、化学的および熱的安定性の増加、プロテアーゼによる分解に対する耐性の上昇、および親油性の向上をもたらします。したがって適切にデザインされたペプチドは、脂質膜に対するより強力な親和性および受容体とのより強い相互作用を示します。電子的および立体的な理由の両方が作用し、トリフルオロメチルアミノ酸ではcis – アミド結合が好まれるため、β-ターンの形成が誘導される結果となります。
また環状ペプチドの合成の場合、環化収率が増加します。
表2. カタログ製品としてご提供可能なトリフルオロメチルアミノ酸
| コード | 製品名 | 分子式 | CAS | 分子量 | 内容量 | 名称 |
| HAA1925.0250 | H-α-Tfm-L-Ala-OH | C4H6F3NO2 | 102210-03-7 | 157.09 | 250mg | (S)-Trifluoromethylalanine |
| HAA1925.0500 | H-α-Tfm-L-Ala-OH | C4H6F3NO2 | 102210-03-7 | 157.09 | 500mg | (S)-Trifluoromethylalanine |
| HAA1925.1000 | H-α-Tfm-L-Ala-OH | C4H6F3NO2 | 102210-03-7 | 157.09 | 1g | (S)-Trifluoromethylalanine |
| HAA1925.5000 | H-α-Tfm-L-Ala-OH | C4H6F3NO2 | 102210-03-7 | 157.09 | 5g | (S)-Trifluoromethylalanine |
| HAA1945.0250 | H-α-Tfm-L-Pro-OH | C6H8F3NO2 | 921224-82-0 | 183.13 | 250mg | (S)-Trifluoromethylproline |
| HAA1945.0500 | H-α-Tfm-L-Pro-OH | C6H8F3NO2 | 921224-82-0 | 183.13 | 500mg | (S)-Trifluoromethylproline |
| HAA1945.1000 | H-α-Tfm-L-Pro-OH | C6H8F3NO2 | 921224-82-0 | 183.13 | 1g | (S)-Trifluoromethylproline |
| HAA1945.5000 | H-α-Tfm-L-Pro-OH | C6H8F3NO2 | 921224-82-0 | 183.13 | 5g | (S)-Trifluoromethylproline |
| HAA1950.0250 | H-α-Tfm-L-Asp-OH*HCl | C5H6F3NO4*HCl | 686318-88-7 | 210.10*36.45 | 250mg | (S)-Trifluoromethylaspartic acid hydrochloride |
| HAA1950.0500 | H-α-Tfm-L-Asp-OH*HCl | C5H6F3NO4*HCl | 686318-88-7 | 210.10*36.45 | 500mg | (S)-Trifluoromethylaspartic acid hydrochloride |
| HAA1950.1000 | H-α-Tfm-L-Asp-OH*HCl | C5H6F3NO4*HCl | 686318-88-7 | 210.10*36.45 | 1g | (S)-Trifluoromethylaspartic acid hydrochloride |
| HAA1950.5000 | H-α-Tfm-L-Asp-OH*HCl | C5H6F3NO4*HCl | 686318-88-7 | 210.10*36.45 | 5g | (S)-Trifluoromethylaspartic acid hydrochloride |
| HAA1960.0250 | H-α-Tfm-L-Ser-OH | C4H6F3NO3 | 168074-56-4 | 173.09 | 250mg | (S)-Trifluoromethylserine |
| HAA1960.0500 | H-α-Tfm-L-Ser-OH | C4H6F3NO3 | 168074-56-4 | 173.09 | 500mg | (S)-Trifluoromethylserine |
| HAA1960.1000 | H-α-Tfm-L-Ser-OH | C4H6F3NO3 | 168074-56-4 | 173.09 | 1g | (S)-Trifluoromethylserine |
| HAA1960.5000 | H-α-Tfm-L-Ser-OH | C4H6F3NO3 | 168074-56-4 | 173.09 | 5g | (S)-Trifluoromethylserine |
| HAA2765.0250 | Tfm-PsiPro-OBn (S,R) | C12H12F3NO3 | 1228376-93-9 | 175.22 | 250mg | (2S,4R)-4-Trifluoromethyl-pseudoproline-benzyl ester |
| HAA2765.0500 | Tfm-PsiPro-OBn (S,R) | C12H12F3NO3 | 1228376-93-9 | 175.22 | 500mg | (2S,4R)-4-Trifluoromethyl-pseudoproline-benzyl ester |
| HAA2765.1000 | Tfm-PsiPro-OBn (S,R) | C12H12F3NO3 | 1228376-93-9 | 175.22 | 1g | (2S,4R)-4-Trifluoromethyl-pseudoproline-benzyl ester |
| HAA2765.5000 | Tfm-PsiPro-OBn (S,R) | C12H12F3NO3 | 1228376-93-9 | 175.22 | 5g | (2S,4R)-4-Trifluoromethyl-pseudoproline-benzyl ester |
開発プロジェクトについて
特定の分子の合成経路、収量および純度を正確に予測することは非常に難しい課題ですが、Iris Biotech社では適切な生産ルートを見つけるために、標的化合物に到達するための手法を練り、研究と複数の予備実験を実施し、堅牢なプロセスに発展させるサービスをご提供しております。
一般的な課題としては下記のようなものが挙げられます
- 次代においても通用する、持続可能な製造の基礎としてのラボスケールde novo合成ルート開発
- 効率的な技術を選択しプロセスの効率を向上させるための、既存の合成ルートの最適化又は再設計
- 目的の分子を得るためのパテントフリーな技術の検索
これより複雑な課題には、受託開発契約として実施されます。
この契約には下記のような開発プロセスを含みます。
- バイオコンジュゲーション
- 分析またはマテリアル開発における特定のアプリケーションに適切な分子またはポリマーの探索
この一連の研究開発は、通常ラボスケールからバルクまでの化合物の製造を含め、持続可能でスケーラブルな合成経路の開発につながります。
コスト計算に関しましては、FTE(Full Time Equivalent)ベースおよびマイルストーンに基づくFee for serviceとなります。
お客様のニーズにあった化合物をご用意し、プロジェクトを円滑に進めるお手伝いをさせていただきます。Iris Biotech社のサービスをぜひご活用ください。
お客様の合成手法に倣ったサンプルの受託合成
緊急に入手する必要のある化合物があるにも関わらず、物理的なスペースや人的資源の不足といった問題を抱えるお客様の代わりに、Iris Biotech社の経験豊富なスタッフがサンプルを合成いたします。
Iris Biotech社は、お客様の合成プロセスを豊富な専門知識で忠実に再現、実行いたします。
プロセスに関するすべての事項は、厳密に機密保持契約によって守られます。
プロジェクトが終了した際には、Iris Biotech社の専門スタッフによって包括的に文書化された手順をお渡しいたしますので、簡便にプロセスを追跡し、再現性を保つことが可能となっています。
